Ungewöhnlich lange "Packungsbeilage" beweist nicht die Unwirksamkeit eines Covid-Impfstoffes
- Dieser Artikel ist älter als ein Jahr.
- Veröffentlicht am 9. Dezember 2024 um 11:50
- 5 Minuten Lesezeit
- Von: Liesa PAUWELS, AFP Niederlande
- Übersetzung und Adaptierung: Lisa-Marie ROZSA
"Schockierend: Die echte Packungsbeilage der Spritzen ist 757 Seiten lang und enthält schwerwiegende Nebenwirkungen", hieß es beispielsweise auf Instagram. In dem Beitrag war ein Ausschnitt aus der niederländischen Talkshow 'De Wereld is Vierkant' von blkbx.tv, einem niederländischen alternativen Fernsehsender, zu sehen. In dem gezeigten Abschnitt der Talkshow wird auf die fragliche "Packungsbeilage" eingegangen und impliziert, dass die Impfstoffe aufgrund der Länge des Dokuments nicht sicher sein könnten.
Ein weiteres Kurzvideo derselben Talkshow wurde über 36.000 Mal auf Instagram angesehen. Unter dem am 4. November 2024 veröffentlichten Beitrag heißt es: "Indem man Widersprüche erkennt und anspricht – in diesem Fall eine 757-seitige Packungsbeilage zu einem 'sicheren und wirksamen' Impfstoff – wird der Weg für Veränderungen geebnet."
Dieselben Behauptungen wurden auch auf anderen Social-Media-Plattformen wie Threads, X und Facebook geteilt.
Bei dem in der Talkshow gezeigten Dokument handelt es sich jedoch nicht um die Packungsbeilage für Patientinnen und Patienten, sondern um die Produktinformation aller bestehenden Varianten des Impfstoffs von BioNTech/Pfizer gegen Covid-19. Diese ist viel detaillierter als eine Packungsbeilage und richtet sich an medizinisches Fachpersonal. Auch Expertinnen und Experten bestätigten gegenüber AFP, dass Produktinformationen immer wesentlich detaillierter und dadurch viel länger seien.
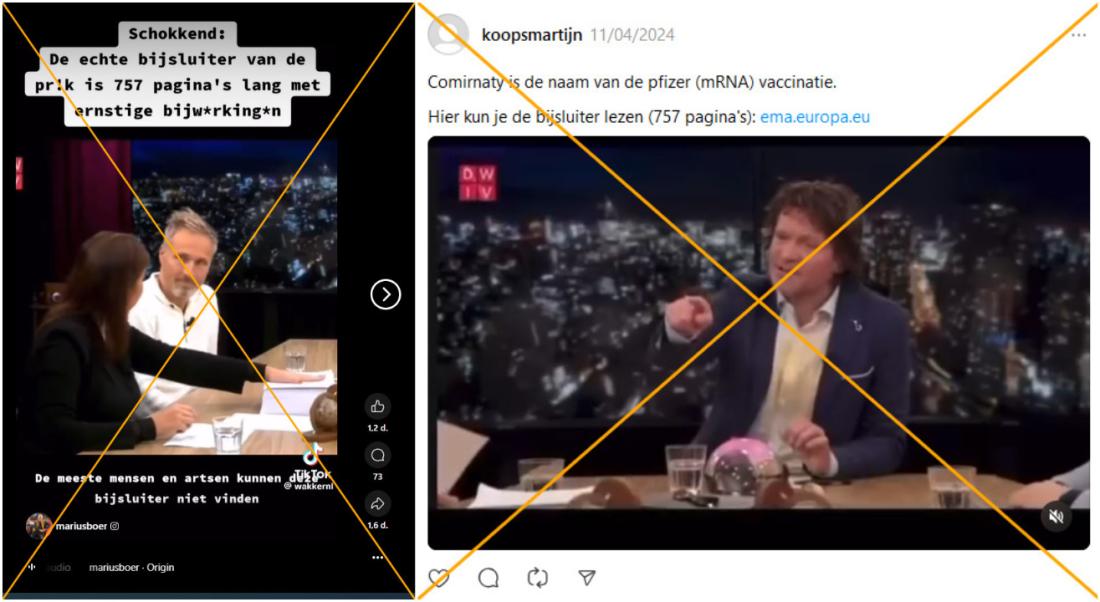
Es handelt sich um die Produktinformation – nicht um die Packungsbeilage
In den Beiträgen verlinken einige Nutzerinnen und Nutzer direkt auf das 757 Seiten lange Dokument, über das die Gäste in der Talkshow sprachen. Dabei handelt es sich um das offizielle Dokument, das auf der Website der Europäischen Arzneimittel-Agentur (EMA) veröffentlicht wurde. Die EMA ist in der Europäischen Union für die Bewertung von Arzneimitteln, die für den EU-Markt zugelassen sind, zuständig.
Das gleiche Dokument wurde auch in der Arzneimitteldatenbank des niederländischen Medicines Evaluation Board veröffentlicht. Dabei handelt es sich um das niederländische Pendant zur EMA – hier werden also Arzneimittel auf nationaler Ebene bewertet. In dem Dokument wird der Markenname des umgangssprachlich als "Pfizer"- oder "BioNTech"-Impfstoff bezeichneten Vakzins verwendet, nämlich Comirnaty.
Anders als in den Beiträgen behauptet, handelt es sich bei dem 757 Seiten langen Text jedoch um die Produktinformation des Impfstoffs und nicht um die Packungsbeilage. Eine Produktinformation wird auch als Zusammenfassung der Produktmerkmale (Summary of Product Characteristics – SmPC) bezeichnet. Die Produktinformation enthält wesentlich detailliertere Informationen als die Packungsbeilage, da sie als Information für medizinisches Fachpersonal gedacht ist und für das Zulassungsverfahren des Medikaments herangezogen wird. In dieser wird nicht nur über mögliche Nebenwirkungen informiert, sondern auch über Dosierung, Verabreichung sowie detaillierte Erklärungen zu den Inhaltsstoffen des Impfstoffs und verschiedenen Varianten des Impfstoffs berichtet. Eine Packungsbeilage hingegen soll Patientinnen und Patienten über den Impfstoff informieren und ist eine vereinfachte Version der Produktinformation.
Anke Huckriede ist Professorin für Vakzinologie an der Universität Groningen in den Niederlanden und erklärte am 25. November 2024 gegenüber AFP, dass es einen großen Unterschied zwischen der Packungsbeilage und der in der Talkshow gezeigten Produktinformation gebe. "Letztere soll die Behörden informieren, die eine Zulassung erteilen müssen, bevor ein Medikament auf den Markt kommt", so Huckriede.
Im Fall des mRNA-Impfstoffs Comirnaty sind in der Produktinformation Zusammenfassungen der durchgeführten klinischen Studien und der erzielten Ergebnisse enthalten. Laut Huckriede "sollte die Tatsache, dass ein so umfassendes Dossier von verschiedenen Fachleuten bewertet wird und auch für jede und jeden zugänglich ist, eigentlich Vertrauen schaffen und die Transparenz des Prozesses belegen".
Sie betonte auch, dass eine "ausführliche Produktinformation nichts mit zusätzlichen Nebenwirkungen oder mehr Risiken zu tun hat".
Informationen zu 21 verschiedenen Varianten des Impfstoffs
Auf eine E-Mail-Anfrage von AFP am 22. November 2024 erklärte ein Sprecher des niederländischen Arzneimittel-Bewertungsausschusses, dass "bei Impfstoffen, die auf europäischer Ebene bewertet und über die EMA registriert werden – wie etwa Comirnaty – die Informationen für jede Variante und Dosisstärke in einem Dokument zusammengefasst werden" – was die Länge des Dokuments erklärt.
Auf eine Frage von AFP bezüglich der Länge des Dokuments schrieb ein EMA-Sprecher am 26. November 2024 in einer E-Mail, dass "die Produktinformationen zu Comirnaty so lang sind, weil sie die Zusammenfassungen der Produktmerkmale (SmPC), Kennzeichnungsinformationen und Packungsbeilagen für alle Stämme, Darreichungsformen und Dosisstärken des Impfstoffs enthalten, die seit der Zulassung der ersten Originalversion im Dezember 2020 genehmigt wurden."
Dies ist auch auf der Comirnaty-Webseite zu lesen. Zusätzlich zur ursprünglich zugelassenen Version des Impfstoffs wurde dieser an vier verschiedene Varianten angepasst, um die neuesten Virusstämme abzudecken. Jeder Impfstoff ist auch in verschiedenen Dosierungen erhältlich, je nachdem, für welche Bevölkerungsgruppe er bestimmt ist – mit einer niedrigeren Dosierung für Säuglinge und Kleinkinder.
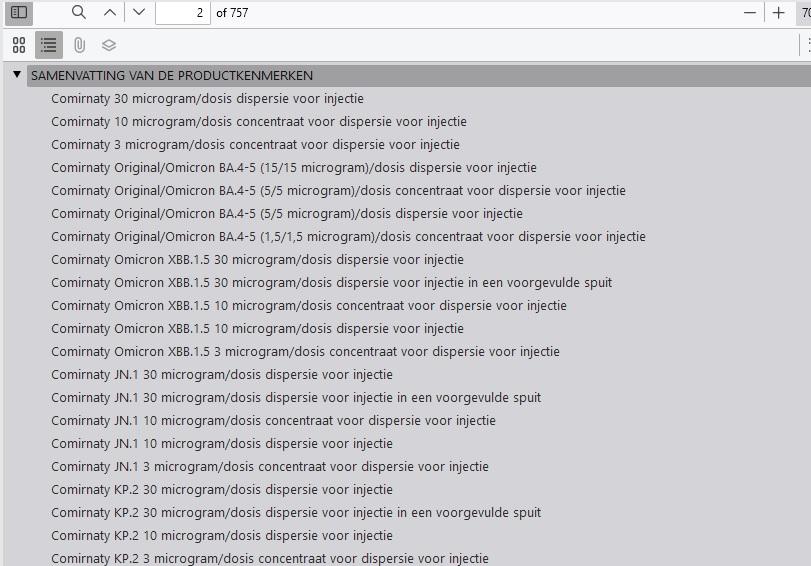
Sieht man sich das Inhaltsverzeichnis der Impfstoff-Produktinformation an, stellt man fest, dass die 757 Seiten tatsächlich aus 21 einzelnen SmPCs oder Produktinformationen, Kennzeichnungsinformationen und Packungsbeilagen bestehen. "Obwohl jede einzelne davon dem entspricht, was normalerweise für jeden Impfstoff gilt, ist es die Summe all dieser verschiedenen Dokumente, die in einem übergreifenden Dokument zusammengefasst sind – was die Länge erklärt", so ein Sprecher der EMA. Er erklärte auch, dass der "Hauptunterschied zwischen Covid-19-Impfstoffen und anderen Impfstoffen für Menschen darin besteht, dass mehrere Zusammensetzungen (Stämme) innerhalb derselben Marktzulassung nebeneinander existieren können. Dies ist für andere Impfstoffe für den Menschen – wie etwa gegen Influenza – nicht zutreffend."
Das hat mit der Änderungsverordnung der EU zu tun: Sie erlaubt das Hinzufügen von Stämmen durch Änderungsverfahren für diese Art von Impfstoffen.
Covid-19-Impfstoffe sind sicher
Huckriede betonte auch, dass es zwar zu schweren Nebenwirkungen kommen kann, diese aber selten auftreten und dass die Covid-19-Impfstoffe sicher seien: "Nachdem wir Milliarden von Dosen des mRNA-Impfstoffs verabreicht haben, wissen wir jetzt, dass schwere Nebenwirkungen zwar auftreten können, dieser aber glücklicherweise sehr selten sind."
Die vollständige Liste der Nebenwirkungen ist in den entsprechenden Informationsdokumenten zu den einzelnen Impfstoffen enthalten und auf der EMA-Website in allen EU-Sprachen verfügbar (hier archiviert).
Der Sprecher der EMA erklärte gegenüber AFP, dass "die in der EU zugelassenen Covid-19-Impfstoffe – einschließlich Comirnaty – sicher und wirksam sind." Er fügte hinzu, dass "die Covid-19-Pandemie das größte Impfprogramm der Geschichte ausgelöst hat und die Aufsichtsbehörden über eine beispiellose Menge an Daten verfügen, um die Sicherheit und Wirksamkeit dieser Impfstoffe zu bestätigen".
AFP hat bereits früher falsche Behauptungen über Covid-19 und Dokumente im Zusammenhang mit dem BioNTech/Pfizer-Impfstoff gegen Covid-19 überprüft.
Fazit: Bei dem 757 Seiten langen Dokument, das in einer niederländischen Talkshow als Packungsbeilage des Impfstoffs von BioNTech/Pfizer gegen Covid-19 gehandhabt wird, handelt es sich um die Produktinformation dieses Impfstoffes. Diese ist viel länger als ein gewöhnlicher Beipackzettel, da sie an medizinisches Fachpersonal gerichtet ist.
Copyright © AFP 2017-2026. Für die kommerzielle Nutzung dieses Inhalts ist ein Abonnement erforderlich. Klicken Sie hier für weitere Informationen.